石藥集團在抗體偶聯(ADC)藥物領域又有新動向,最新公告顯示,其開發的抗體藥物偶聯物CPO301的試驗性新藥申請(IND)已獲美國食藥監局(FDA)批準,可在美國開展臨床試驗。在ADC藥物領域,石藥集團頻現海外授權,且已有收獲。
在研藥物用于晚期肺癌
 【資料圖】
【資料圖】
此次獲得FDA批準的項目為一項多中心、劑量遞增和劑量擴展的Ⅰ期臨床試驗,以評估CPO301用于治療EGFR基因突變或EGFR過表達的晚期肺癌的安全性、藥物動力學及初步療效。
肺癌是發病率和死亡率最高的惡性腫瘤之一,估計全球每年有超過220萬人診斷患有肺癌,超過170萬人死于肺癌。EGFR激活突變是肺癌主要驅動基因之一,也是眾多已批準EGFR酪氨酸激酶抑制劑(TKI)的靶點,包括第一代、第二代和第三代TKI(如奧希替尼)。不過,約有25%非小細胞肺癌患者在接受奧希替尼治療后會出現新突變,除挽救性化療外沒有其他有效治療方法,為TKI治療帶來新挑戰。
臨床前研究顯示,CPO301呈劑量依賴性地抑制免疫缺陷小鼠中具有各種EGFR激活突變或野生型EGFR高表達模型的人類腫瘤的生長。CPO301尤其在含有針對三代EGFR-TKI奧希替尼耐藥的、EGFR三重突變的人源化非小細胞肺癌PDX模型中,顯示出很強的抗腫瘤效果。CPO301在臨床前毒理學和安全藥理學研究中均顯示良好的安全性和耐受性,該等數據支持CPO301用于治療晚期非小細胞肺癌的快速開發。
ADC藥物由抗體、連接子和毒素三部分偶聯而成。理論上來講,任何一個部分都可與其他部分進行偶聯,這意味著,通過多樣“組合”,可迭代出新產品。正因如此,ADC藥物有“生物導彈”之稱,也被業界認為或將成為下一個平臺級產品。
正因如此,ADC藥物市場規模不容小覷。公開數據顯示,2024年-2030年全球ADC藥物市場規模有望達到104億美元、207億美元;中國ADC治療市場預計將分別達74億元、292億元的規模。
布局ADC領域有所收獲
國內有君實生物、張江生物、華海藥業(600521)、華東醫藥(000963)等50多家企業爭相布局,石藥集團也是其中一員,且已有所收獲。
2022年7月,石藥集團與美國Elevation Oncology, Inc. 簽訂獨家授權協議,向后者授出SYSA1801(Claudin 18.2 ADC)項目在大中華地區以外的開發及商業化權利。基于此,石藥集團獲得2700萬美元首付款,并有權收取最多1.48億美元潛在開發及監管里程碑付款,及最多10.2億美元潛在銷售里程碑付款以及分層銷售提成。今年1月,石藥集團又與美國Corbus Pharmaceuticals, Inc. 簽訂獨家授權協議,向其授出SYS6002(Nectin-4 ADC)項目在美國、歐盟國家、英國、加拿大、澳大利亞、冰島、列支敦士登、挪威及瑞士的開發及商業化權利。在此次授權中,石藥集團獲得750萬美元首付款,并有權收取最多1.3億美元潛在開發及監管里程碑付款,及最多5.55億美元潛在銷售里程碑付款以及分層銷售提成。
ADC市場火熱,監管層也在引導相關研究。2022年9月,國家藥監局藥品審評中心組織撰寫的《抗腫瘤抗體偶聯藥物臨床研發技術指導原則》征求意見稿提出,臨床研發應關注同一靶抗原不同藥物間療效差異、最佳給藥方案探索等要點。在ADC藥物臨床研發過程中,除必須遵循抗腫瘤藥物的一般研發規律,還應該注重以臨床需求為出發點,結合分子結構和機制特征,關注臨床研發要點,深入探索分析自身臨床優勢,合理制定開發策略。
東北證券此前也在研報中指出,ADC藥物廣泛布局腫瘤領域,從總體來看,本土在研管線總數較少,適應癥、靶點分布較為集中,熱門靶點HER2占比超過30%。此外,已經有部分企業在探索創新靶點,該類靶點賽道尚未形成明顯競爭格局,仍然具有較大的發展潛力。




 中國無人駕駛技術初創公司文遠知行考慮IPO 最早于今年上市
中國無人駕駛技術初創公司文遠知行考慮IPO 最早于今年上市
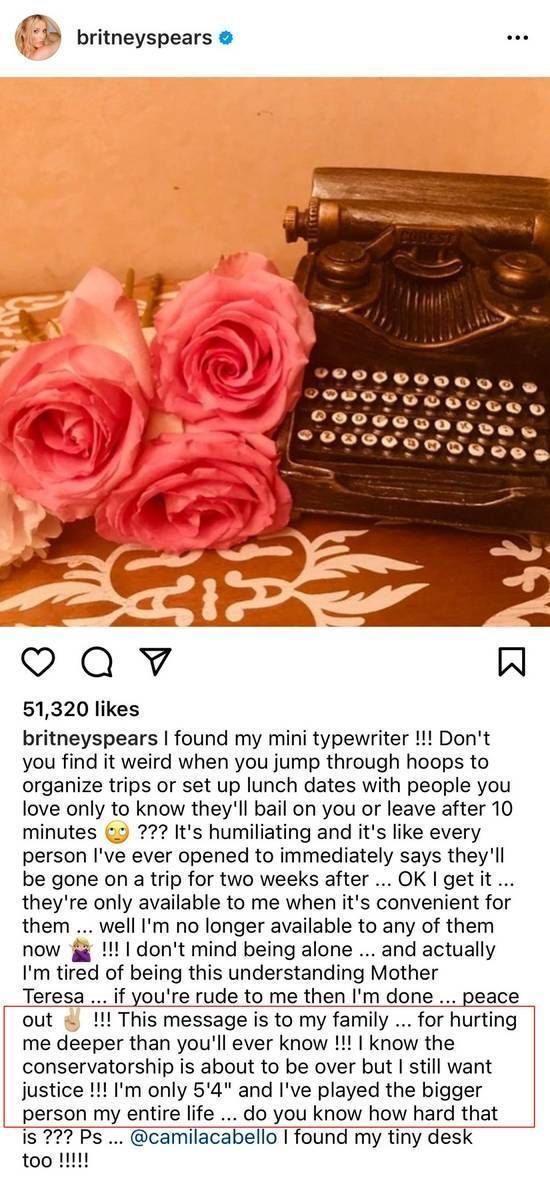
 寧德時代上半年營業收入同比增156.32% 研發投入逼近同期凈利
寧德時代上半年營業收入同比增156.32% 研發投入逼近同期凈利
 蘭博基尼上半年業績創紀錄 上半年生產5090輛汽車
蘭博基尼上半年業績創紀錄 上半年生產5090輛汽車
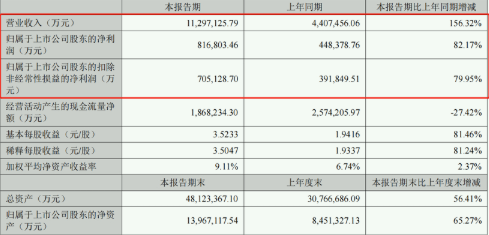
 傳特斯拉或引入另一家壓鑄機供應商 不會取消與IDRA合作
傳特斯拉或引入另一家壓鑄機供應商 不會取消與IDRA合作
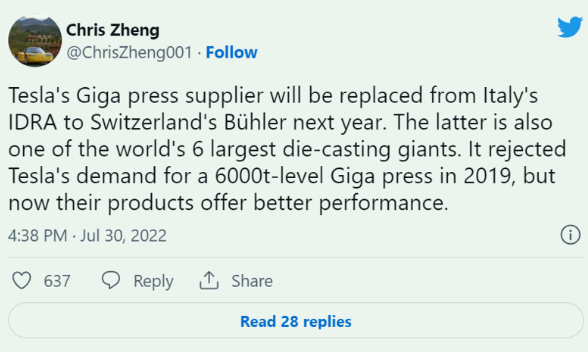
 高油價有助于加速向電動汽車轉型 英國5月汽車產量同比增13%
高油價有助于加速向電動汽車轉型 英國5月汽車產量同比增13%